O oxigênio, cujo símbolo é O, é um elemento químico da tabela periódica. A massa atômica do oxigênio é 16 u (Dalton, unidade de medida atômica) e seu número atômico é 8.Esse elemento químico foi batizado por Lavoisier no ano de 1774.
Em temperatura ambiente e na forma gasosa, o oxigênio é um elemento inodoro (e sem cheiro) e insípido (sem gosto). Contudo, quando está no estado sólido ou no estado líquido, o oxigênio apresenta coloração azul. O oxigênio é comburente e também é pouco solúvel na água.
O oxigênio representa aproximadamente 20% da atmosfera da Terra e é encontrado como de três isótopos: o oxigênio 16, o oxigênio 17 e o oxigênio 18. O oxigênio 16 está em 99,75% da natureza; o oxigênio 17 está presente em 0,37% e o oxigênio 18 está presente em 0,20%.
O oxigênio é mais pesado que o ar: 1,1 vezes, aproximadamente e é muito usado como oxidante. Esse uso acontece por causa da sua imensa eletronegatividade. A eletronegatividade do oxigênio é tão grande que é superada apenas pela do flúor. Por conta disso, o oxigênio é bastante usado na função de comburente de motores.

Na Medicina, o oxigênio é utilizado no tratamento de pacientes com problemas respiratórios. Basta observar os aparelhos hospitalares de inalação, que fornecem oxigênio. Porém, quando inalado, o elemento pode causar sensação de euforia e, no século XIXI, ele era utilizado como analgésico, sendo misturado com o oxido nitroso.
A indústria também usa o oxigênio. Ele está presente em soldas e atua no processo de fabricação de metanol e de aço. Os esportistas se utilizam do oxigênio na em práticas como o mergulho: engarrafado, ele permite que se respire em ambientes onde isso não seria possível, como embaixo da água.
Para os seres vivos aeróbicos, o oxigênio tem um papel muito importante: ele participa da transformação dos nutrientes em energia. O oxigênio respirado por esses seres é liberado através do processo de alimentação das plantas, chamado fotossíntese. Além disso, a hemoglobina, responsável pela cor dos olhos, também distribui o oxigênio pelo corpo.
O oxigênio também é utilizado na queima de outros combustíveis orgânicos e, como exemplo, podemos citar:
Querosene (C15H3) => em aviões
Óleo Diesel (C18H38) => Navios, Caminhões, etc.
Glicose (C6H12O6) => No Sangue durante a respiração.
Acetileno (C2H2) => Nos maçaricos oxiacetilenicos, para corte de barras, chapas, trilhos, etc.
Ocorrência
O oxigênio é o elemento mais abundante da natureza. As principais ocorrências são:
a) 21% na atmosfera (em volume);
b) 89% na água dos oceanos, lagos, mares, gelos polares, etc (em peso);
c) 47% na crosta terrestre (até a profundidade de 15 km).
Ciclo do Oxigênio
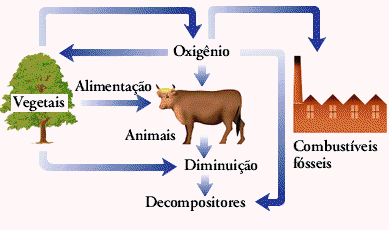
A atmosfera contém 21% de oxigênio, usado pelas plantas e pelos animais durante a respiração. Além disso, fungos e muitas bactérias utilizam oxigênio quando decompõe plantas e animais mortos. Queimar madeira e outros combustíveis também exige oxigênio. As plantas devolvem oxigênio para o ar durante a fotossíntese.
Os ciclos do oxigênio e do carbono estão ligados: a fotossíntese consome dióxido de carbono e produz oxigênio, a respiração por sua vez, consome o oxigênio e produz dióxido de carbono. Pela figura abaixo, é mais fácil compreender como se dá o ciclo do oxigênio:
Origem do nome: Do grego oksús: agudo; ácido; penetrante + genia: nascimento = ácido formador.
Descobridor: O oxigênio foi descoberto pelo farmacêutico sueco Carl Wilhelm Scheele (1742-1786), na Suécia, e pelo químico inglês Joseph Priestley (1733-1804). O nome foi dado pelo cientista francês Antoine Laurent Lavoisier (1743-1794).
Ano de descoberta: 1774
Número atômico (Z): 8
Massa atômica: 15,9994
Família: 16
Período: 2
Configuração eletrônica: [He]2s22p4
Raio atômico: 60 pm
Estado de agregação da substância simples (CNTP): gasoso
TE (substância simples): -182,9 °C
TF (substância simples): -218,3 °C
Por: Márcia Miriam Gomes