A calorimetria é a parte da Termologia que estuda as trocas de calor entre corpos.
Calor é energia térmica em trânsito. Calor sensível é o que acarreta variação de temperatura ao ser recebido ou perdido por um corpo. Calor latente é o calor recebido ou perdido durante uma mudança de estado.
Quantidade de calor (Q) é a grandeza através da qual avaliamos a energia térmica em trânsito trocada entre sistemas a diferentes temperaturas.
A Caloria é a unidade usual de quantidade de calor. A unidade oficial (SI) é joule. Relação: 1 cal = 4,186 j.
O calor específico de uma substância mede numericamente a quantidade de calor recebida ou perdida por um grama da substância ao sofrer a variação de temperatura 1°C, sendo usualmente expressa em cal/g°C.
1. QUANTIDADE DE CALOR (ΔQ)
É a medida da energia térmica fornecida por um corpo para outro. Essa energia é chamada Calor. Sua unidade é a caloria e representa-se cal. Também utiliza-se o múltiplo kcal para 1000 calorias. Embora não muito utilizado, no sistema internacional de unidades utiliza-se o joule (J) e temos as seguintes equivalências:
2. CAPACIDADE TÉRMICA (C)
É a quantidade de calor necessária para variar em 1ºC a temperatura de todo um corpo.
a unidade é cal/ºC ou J/%C
3. CALOR ESPECÍFICO (c)
É a quantidade de calor necessária para variar em 1ºC a temperatura de 1g de um corpo. Corresponde a capacidade térmica por unidade de massa.
4. EQUAÇÃO FUNDAMENTAL DA CALORIMETRIA
5. PRINCÍPIO DA IGUALDADE DAS TROCAS DE CALOR
De acordo com o Princípio da Conservação de Energia, a quantidade de calor cedida por um corpo somada com a quantidade de calor que o outro corpo recebeu é nula.
6. CALOR SENSÍVEL
Quando o efeito produzido pelo fornecimento de calor é a variação da temperatura.
7. CALOR LATENTE
Quando o efeito produzido pelo fornecimento de calor é a mudança de estado, não havendo variação na temperatura.
8. CALORÍMETRO
Recipiente destinado a medir a quantidade de calor cedida ou recebida por um corpo.
O calorímetro de água, um dos mais simples, tem sua constituição formada por um recipiente de alumínio, ferro ou cobre o qual é envolto por um material isolante, por exemplo o isopor. Esse recipiente contem água numa quantidade conhecida. Na parte superior desse recipiente encontra-se um termômetro.
Seu uso dá-se da seguinte maneira: aquecemos uma amostra do material cujo calor específico desejamos conhecer, até que ela atinja uma determinada temperatura![]() ; agitamos então a água do calorímetro e medimos sua temperatura (
; agitamos então a água do calorímetro e medimos sua temperatura (![]() 1); rapidamente colocamos a amostra no calorímetro, agitamos novamente a água e então medimos a temperatura (
1); rapidamente colocamos a amostra no calorímetro, agitamos novamente a água e então medimos a temperatura (![]() f) de equilíbrio entre a água contida no recipiente e a amostra. Como não há perdas de calor para o ambiente durante a experiência, o calor cedido pela amostra ao resfriar-se é igual, em valor absoluto, ao calor ganho pela água.
f) de equilíbrio entre a água contida no recipiente e a amostra. Como não há perdas de calor para o ambiente durante a experiência, o calor cedido pela amostra ao resfriar-se é igual, em valor absoluto, ao calor ganho pela água.
Exemplo:
1.Dentro de um calorímetro, cuja capacidade térmica é desprezível, colocou-se um bloco de chumbo com 4kg, a uma temperatura de 80ºC. O calorímetro contem 8kg de água a uma temperatura de 30ºC. Considerando cchumbo=0,0306cal/g.ºC e cágua=1 cal/g, determinar a temperatura final do sistema.
Resolução: o sistema atinge o equilibrio termico quando todas as suas partes estão à mesma temperatura. Sabendo que o calorímetro não troca calor, podemos dizer que:
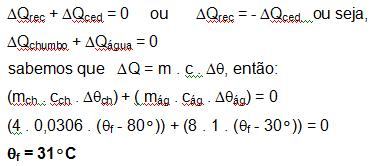
EQUIVALÊNCIA ENTRE CALOR E ENERGIA MECÂNICA
Uma maneira de aumentarmos a temperatura de um corpo é executando-se um trabalho mecânico sobre esse corpo, por exemplo, quando batemos com um martelo a cabeça do prego aumenta sua temperatura; os bifes quando são batidos pelo batedor de carne descongelam-se. Esta descoberta foi feita e enunciada por Joule e é devido a ele que uma das maneiras de representar-se calor é utilizando a letra J de Joule.
Por: Jose Antonio Colvara