A sobrefusão é o fenômeno que consiste em uma substância encontrar-se no estado líquido numa temperatura abaixo da sua temperatura de solidificação.
Para melhor entendimento, tomemos como exemplo o hipossulfito de sódio, que é uma substância para a qual a sobrefusão é muito comum.
Observe a curva de resfriamento de uma porção de hipossulfito de sódio.
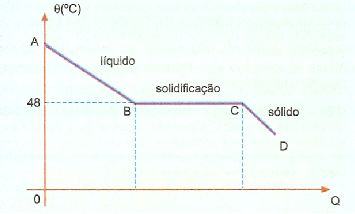
A temperatura de fusão (ou de solidificação) do hipossulfito de sódio é 48°C. Porém, se resfriarmos lentamente, sem provocar agitação em sua massa, o hipossulfito de sódio atingirá temperatura bem abaixo de 48°C, permanecendo no estado líquido abaixo da temperatura de solidificação (48°C). Esse fato é chamado de sobrefusão ou superfusão.
A curva de resfriamento do hipossulfito de sódio, com sobrefusão, toma o seguinte aspecto.
A sobrefusão é um estado de equilíbrio muito instável de tal forma que, se jogarmos no sistema líquido um cristal do sólido correspondente ou se agitarmos o. sistema, parte do líquido se solidifica rapidamente — trecho EF e o sistema volta (se aquece) à temperatura de solidificação — ponto F. A partir do ponto F, o fenômeno da solidificação desenrola-se normalmente, estando, a partir do ponto C, todo o sistema no estado sólido.
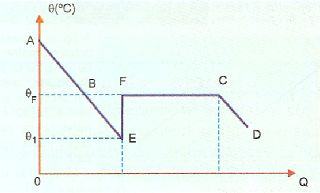
Observemos que no diagrama o trecho AE corresponde ao resfriamento do líquido, sendo que no trecho BE o líquido está em sobrefusão. Ao ser provocado o distúrbio no sistema, há solidificação repentina de uma parcela m5 da massa total m. Esta solidificação liberta calor que fica no próprio sistema, provocando o seu aquecimento e a volta à temperatura de solidificação.
Assim: QBF = QBE + QEF
Como a solidificação parcial e o correspondente aquecimento (trecho EF) são muito rápidos, esse processo é adiabático e QEF = 0.
Portanto: QBF = QBE mSLS = mclíq (θf – θ1)
Por: Renan Bardine