O alumínio, na forma metálica, é de cor branco-prateada, de baixa densidade, não-magnético, resistente à corrosão e bom condutor de calor.
O alumínio está presente em substâncias que fazem parte da composição de várias rochas, como feldspatos, bauxita e criolita, e de pedras preciosas, como safiras e rubis.
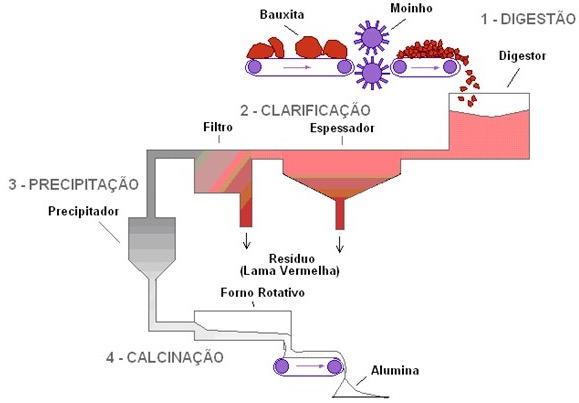
A bauxita é o minério mais importante para a obtenção de alumínio e a base para sua aquisição por meio da eletrólise. Nesse processo, primeiro é feita a purificação da bauxita pela reação com o hidróxido de sódio. Disso resulta o hidróxido de alumínio, que, ao ser aquecido, produz o oxido de alumínio, o qual sofre redução eletrolítica para produzir o alumínio metálico. A adição de criolita ao recipiente em que é feita a eletrólise reduz a temperatura de fusão da alumina (oxido de alumínio).
O alumínio também pode ser obtido pela eletrólise do cloreto de alumínio em fusão.
As principais substâncias em que o alumínio está presente são o oxido de alumínio (Al203), o hidreto de alumínio (AIH3), o hidróxido de alumínio (AI(OH)3) e o cloreto de alumínio (AICI3).
Aplicações:
Grande parte da produção mundial de alumínio é destinada às indústrias aeronáutica e automobilística. A liga de alumínio e magnésio é usada na construção naval; a liga de alumínio e silício é empregada na indústria automobilística e na fabricação de componentes elétricos; a liga de alumínio, cobre e magnésio é utilizada na produção de automóveis e aviões. As ligas de alumínio também são empregadas na produção de utensílios domésticos (como panelas) e na fabricação de janelas, portas, divisórias, grades, papel decorativo, explosivos, telescópios e embalagens.
Além disso, por causa de sua baixa densidade, o alumínio pode ser usado como condutor para linhas de transmissão de eletricidade e, por ser resistente, o oxido de alumínio é empregado na confecção de tijolos refratários.

Outra importante aplicação desse metal é a confecção de arame, em que pode ser usado o metal puro ou uma de suas ligas.
Origem do nome: Do latim alumen: pedra-ume.
Descobridor: Foi descoberto pelo químico dinamarquês Hans Christian Oersted (1777-1851) e isolado pelo químico alemão Friedrich Wõhler (1800–1882), em 1827.
Ano de descoberta: 1825
Número atômico (Z): 13
Massa atômica: 26,9815
Família: 13
Período: 3
Configuração eletrônica: [Ne]3s23p1
Raio atômico: 125 pm
Estado de agregação da substância simples (CNTP): sólido
TE (substância simples): 2519 °C
TF (substância simples): 660,32 °C