A última coluna da tabela periódica é formada por elementos com características muito particulares, são os conhecidos gases nobres (ou gases raros). A família dos gases nobres, também denominada família 0 ou VIIIA, é composta por 6 elementos: Hélio (He), Neônio (Ne), Argônio (Ar), Kriptônio (Kr), Xenônio (Xe) e Radônio (Rn).
Como o próprio nome já sugere, esses elementos são encontrados naturalmente no estado gasoso. Em condições ambiente, as substâncias simples desses gases são formadas por átomos isolados dos elementos, ou seja, o gás hélio é formado por um único átomo de hélio, o gás neônio é formado por apenas um átomo de neônio, e assim por diante. Isso porque os átomos dos gases nobres são altamente estáveis, apresentando pouca tendência de se combinarem entre si ou com outros átomos.
Essa baixa reatividade dos gases nobres se deve à sua elevada energia de ionização, à baixa eletroafinidade dos átomos de seus elementos e, principalmente, à configuração eletrônica completa na última camada. Os átomos de todos os gases nobres, com exceção do hélio, apresentam sempre 8 elétrons na última camada eletrônica, denominada camada de valência. Observe a tabela:
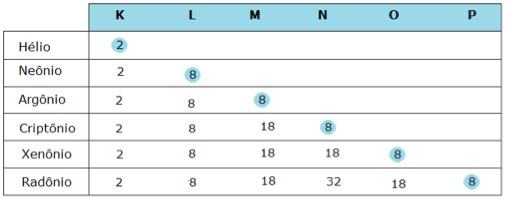
Ao associar o fato de que os átomos dos gases nobres apresentam pouca tendência a se combinarem com outros átomos com o fato que de que esses mesmos átomos possuem o número máximo de elétrons na última camada (8 elétrons, ou 2, como ocorre com o hélio), os cientistas Gilbert Newton Lewis e Walter Kossel propuseram a hipótese: ao se combinarem, os átomos perdem, ganham ou compartilham elétrons na última camada para que alcancem a configuração eletrônica de um gás nobre. Essa hipótese ficou conhecida, então, como regra do octeto, e diz que:
Um átomo atinge a estabilidade quando tem 8 elétrons na camada de valência, ou 2 elétrons quando possui apenas uma camada (K).
Conheça agora um pouco de cada um dos gases nobres.
Hélio – gás muito abundante no universo, encontrado, em especial, na composição de estrelas. Foi descoberto a partir de estudos acerca do espectro da luz solar, por isso recebeu o nome hélio, do grego helios, que significa sol. É muito utilizado no enchimento de dirigíveis, bexigas e balões de publicidade e meteorologia. Também é usado em cilindros de ar para mergulhadores de altas profundidades, misturado com o oxigênio.
Neônio – descoberto pelo químico francês Willian Ransay no final do século XIX, é muito utilizado em letreiros luminosos, que, por isso, são chamados de anúncios de neon. Também é um dos constituintes de detectores de íons usados em laboratórios.
Argônio – é um gás relativamente abundante na atmosfera, perfazendo aproximadamente 1% da composição do ar, em volume. É usado na fabricação de lâmpadas incandescentes, lasers, contadores Geiger, luminosos azuis, entre outros. Também é aplicado à conservação de peças de museus e em soldagens.
Criptônio – é um gás bastante raro na atmosfera, muito utilizado em lâmpadas incandescentes e fluorescentes, flashs fotográficos e projetores cinematográficos.
Xenônio – é usado em lâmpadas para bronzeamento artificial e em muitos outros dispositivos de emissão de luz. É também empregado na Medicina como anestésico, especialmente em anestesias gerais.
Radônio – foi isolado pela primeira vez no início do século XX, vem sendo utilizado em radioterapias, além de ser muito usado em sismógrafos e como indicador de fuga de gases.
Referências bibliográficas
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 20
Por: Mayara Lopes Cardoso