Conhecer a quantidade de soluto em relação à quantidade de solvente é muito importante e é o que vamos estudar em concentração das soluções. Não é a mesma coisa beber um copo de água com algumas gotas de álcool e beber um copo de álcool com algumas gotas de água.
Em uma análise de sangue ou de urina, medem-se as quantidades de determinadas substâncias. Os resultados servem para detectar enfermidades.
Um plasma sanguíneo que apresente 90 mg de glicose por 100 cm, por exemplo, leva a um diagnóstico completamente diferente de outro que apresente 150 mg de glicose na mesma quantidade de plasma. No segundo caso, há uma enfermidade: a diabetes. Para essa e outras constatações, apoia-se na definição de uma grandeza denominada concentração.
Uma solução é dita saturada quando a quantidade de soluto dissolvido é igual ao limite determinado pelo seu coeficiente de solubilidade. Se, no entanto, a quantidade de soluto dissolvido é inferior ao limite, tem-se uma solução insaturada.
Quanto menor a quantidade de soluto presente em determinada quantidade de solvente, mais diluída é a solução (a água do mar, por exemplo, é uma solução diluída de cloreto – de sódio).
O contrário de solução diluída é solução concentrada, na qual a quantidade de soluto dissolvido é grande.


Formas de expressar a concentração
As expressões solução diluída e solução concentrada não fornecem dados precisos em relação à quantidade exata de soluto que está presente em certa quantidade de solvente – ou de solução. Há, no entanto, diversas maneiras de obter esse valor.
- Uma delas é expressar a massa de soluto em gramas contido em 100 g de água.
- Outra, bastante empregada, é a porcentagem em massa de soluto, que indica a massa de soluto presente em 100 g de solução.
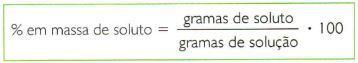
- Outra forma, também muito adotada, é a concentração em gramas por litro.
O resultado indica a massa em gramas de soluto contida em cada litro de solução.
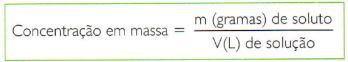
No SI, a unidade adequada para expressar a concentração de uma solução é kg/m3, mas a mais usada é g/L.![]()

Para preparar esta solução, introduzem-se 128 gramas de nitrato de potássio em um béquer com menos de um litro de água destilada, agita-se e, quando se obtém uma mistura homogênea, transfere-se essa mistura para um balão volumétrico de 1 L de volume. O volume é completado com água destilada.
O rótulo indica que, para 100 gramas de solução, 36 gramas são de nitrato de sódio e 64 gramas são de água. Para preparar um litro dessa solução (1,250 gramas), basta pesar 1250 x 36% = 450 gramas de sal e dissolvê-los em 1250 – 450 = 800 gramas de água (ou 800 cm3 de água).
Cálculo da concentração das soluções:
1 – Em 200 g de água, dissolvem-se 25 g de um soluto. Qual é a porcentagem em massa de soluto na solução?
Massa da solução: 200 g de solvente + 25 g de soluto = 225 g
2 – A concentração de uma solução é 60 g/L. Qual é a massa de soluto contido em 200 cm3 dessa solução?
200 cm3 equivalem a 0,2 L

m (soluto) = 0,2 · 60 = 12 g de soluto
Por: Paulo Magno Torres