Sabemos que a velocidade de uma reação química depende, exclusivamente, do número de colisões entre as moléculas, da energia com que essas colisões ocorrem e da adequada orientação das moléculas no instante da colisão. Entretanto, existem certos fatores externos que influenciam a velocidade das reações, os quais estão relacionados a seguir.
1. Temperatura
Quando a temperatura aumenta, a velocidade das partículas que constituem os reagentes aumenta e, portanto, o número de colisões e a violência com que elas acontecem também aumentam.
O resultado é uma maior velocidade da reação.
Admite-se, de maneira aproximada, que a cada 10 °C de aumento da temperatura, a velocidade da reação duplica
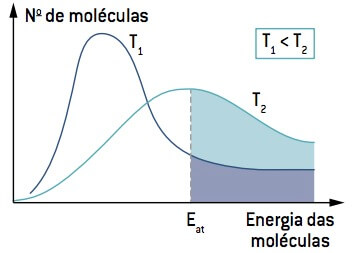
Observando a imagem, note que, numa temperatura menor que T1, a quantidade de moléculas em condições de reagir (com energia igual ou superior a Ea) é menor que numa temperatura maior que T2. O aumento na temperatura faz com que ocorra aumento da energia cinética média das moléculas, deslocando a curva para a direita e fazendo com que aumente o número de moléculas em condições de reação.
Portanto, a baixa temperatura pode diminuir a rapidez das reações que contribuem para a degradação de certos alimentos, e é por causa disso que muitos alimentos devem ser conservados sob refrigeração
2. Superfície de contato entre os reagentes
Se os reagentes estão em estado sólido, sua pulverização, ou seja, a redução a partículas de menor tamanho, aumenta enormemente a velocidade da reação, uma vez que facilita o contato entre os reagentes e, portanto, a colisão entre as partículas.
Por exemplo, a velocidade de combustão do carbono é maior quando ele está sob a forma de pedaços pequenos. Se ele estiver na forma de pó, a velocidade de queima será tão alta que poderá haver uma explosão.
Ao adoçar um cafezinho utilizando uma colher de açúcar, refinado ou cristal, o gosto ao final da dissolução total do açúcar será o mesmo; porém, é fácil observar que o açúcar refinado (maior superfície de contato) dissolve mais rapidamente se comparado ao açúcar cristal (menor superfície de contato).
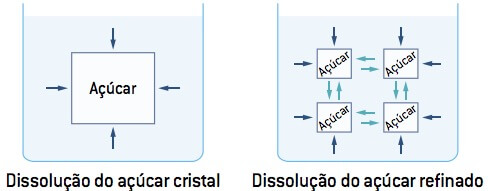
Observação: Quando a reação pode ocorrer com reagentes em diferentes estados físicos, sua velocidade é maior no estado gasoso que no estado líquido e, neste, é maior que no estado sólido.
3. Natureza química dos reagentes que participam da reação
Dependendo do tipo de reagente, a reação terá uma energia de ativação maior ou menor. A energia de ativação é a energia que deve ser fornecida aos reagentes para se obter a substância intermediária (complexo ativado).
- Se a energia de ativação for alta, a reação será lenta.
- Se a energia de ativação for baixa, a reação será rápida.
Assim, por exemplo, se se pensar na oxidação dos metais, a oxidação do sódio é muito rápida, enquanto a da prata é muito lenta e a do ferro é intermediária.
4. Concentração dos reagentes
Se os reagentes estiverem em dissolução ou forem gases contidos em um recipiente fechado, quanto maior sua concentração, maior a velocidade da reação, uma vez que, ao haver mais partículas no mesmo espaço, aumentará o número de colisões entre elas.
O “ataque” dos ácidos aos metais, que ocorre com desprendimento de hidrogênio, será tão mais violento quanto maiores forem as concentrações dos ácidos.
Quando bebês prematuros nascem, necessitam de cuidados especiais e, para isso, são colocados em estufas. Nelas, é possível aumentar a concentração de oxigênio fornecida para as crianças. Assim, as reações de oxigenação do corpo dessas crianças são aceleradas e elas gastam menos energia.
A variação da velocidade da reação com as concentrações dos reagentes é expressa, de maneira geral, pela fórmula:
v = k [A]β [B]β
em que α e β são expoentes que, em alguns casos, coincidem, respectivamente, com os coeficientes de A e de B em uma reação. A constante k é chamada constante de velocidade da reação e depende da temperatura.
5. Catalisadores
Os catalisadores são substâncias que facilitam a reação química, modificando a velocidade com que ela ocorre.
São adicionados em pequenas quantidades e são bastante específicos, isto é, cada catalisador serve para determinado tipo de reação.
Eles não podem provocar as reações nem alterar a energia liberada ou absorvida por elas. Além disso, como não são consumidos no processo, podem ser recuperados ao término dele.
Nas reações que ocorrem nos seres vivos, os catalisadores são chamados enzimas.
A velocidade de uma reação catalisada é aumentada, pelo fato de o catalisador promover uma diminuição na energia de ativação dessa reação, como mostra a figura abaixo.
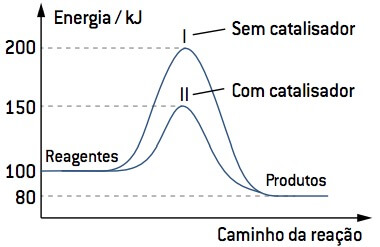
Existem dois tipos de reação envolvendo catalisadores, a catálise homogênea, na qual o catalisador se encontra no mesmo estado físico dos reagentes, e a catálise heterogênea, em que o catalisador se encontra em estados físicos diferentes dos reagentes.
6. Pressão
Ao falarmos em influência da pressão na velocidade de uma reação, é importante frisar que esse parâmetro tem influência somente nos reagentes gasosos. À medida que aumenta a pressão parcial de um gás aumenta-se o número de colisões e, portanto, a velocidade.
2 H2(g) + O2(g) → 2 H2O(g)
Maior pressão parcial dos reagentes gasosos ⇒ maior velocidade da reação
Por: Paulo Magno da Costa Torres