Foi em 1849 que Germain Henri Hess, médico e químico que nasceu na Suíça, mas viveu na Rússia, enunciou a lei da aditividade dos calores, hoje também conhecida como lei de Hess:
“A quantidade de calor liberada ou absorvida numa reação química depende apenas dos estados inicial e final e não dos estados intermediários.”
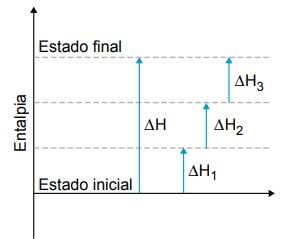
De acordo com a lei de Hess, para encontrarmos o ∆H de uma reação podemos seguir dois caminhos:
- No primeiro caminho, o sistema passa diretamente do estado inicial ao estado final e a variação de entalpia da reação (∆H) é medida experimentalmente: ∆H = Hf – Hi;
- No segundo, o sistema passa de um estado inicial para um ou vários estados intermediários, até chegar ao estado final. A variação de entalpia da reação (∆H) é determinada pela soma algébrica dos ∆H das etapas intermediárias: ∆H = ∆H1 + ∆H2 + ∆H3 + …
É importante destacarmos que o ∆H para uma mesma reação é o mesmo, independentemente de seguirmos o caminho I ou o II.
Por exemplo:
Para utilizarmos a lei de Hess, é importante fazermos as seguintes observações:
- quando invertemos uma equação química, devemos trocar o sinal do ∆H;
- quando multiplicamos ou dividimos uma equação por um número, o ∆H da reação fica multiplicado ou dividido por esse número.
Como resolver exercícios utilizando a Lei de Hess
Na resolução dos exercícios, precisamos observar a posição e o coeficiente das substâncias que pertencem à equação-problema e não são comuns às equações auxiliares; caso sejam comuns às equações auxiliares, estas devem ser ignoradas.
Quando a substância apresentar coeficiente diferente, a equação auxiliar deve ser multiplicada por um número, de modo que a substância fique com o mesmo coeficiente da equação-problema (não esquecer de multiplicar também o ∆H).
Quando a substância se encontrar numa posição inversa à da equação-problema, faça a inversão da equação auxiliar (não se esqueça de inverter o sinal do ∆H).
Exercícios resolvidos
1. Calcule a entalpia da reação: C (grafite) + ½ O2 g→ CO(g) sabendo-se que:
CO(g) + ½ O2(g) → CO2 (g) ∆H = – 282,56 kJ
C(grafite) + O2(g) → CO2 (g) ∆H = – 392,92 kJ
Resposta:
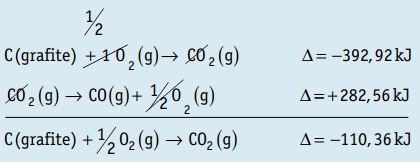
2. Calcule o ∆H da seguinte equação: C (grafite) + 2 H2(g)→ CH4(g) sabendo-se que:
C(grafite) + O2(g) → CO2(g) ∆H = – 393,33 kJ
H2(g) + ½ O2(g) → H2O(l) ∆H = – 285,50 kJ
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ∆H = – 886,16 kJ
Resposta:
A primeira equação permanece inalterada, multiplicamos a segunda equação por 2 e invertemos a terceira equação.
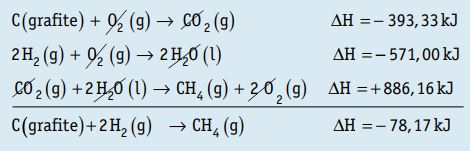
Por: Wilson Teixeira Moutinho