A pressão de vapor de um líquido é a pressão exercida por seus vapores quando estão em equilíbrio dinâmico com o respectivo líquido, numa dada temperatura.
Em nosso dia a dia, poucas vezes nos damos conta de que as substâncias evaporam, embora esse fenômeno aconteça constantemente. Quando lavamos nossas roupas e as estendemos num varal, depois de algum tempo, elas estão secas. Mas, por que isso ocorre?
As moléculas de uma substância líquida estão em constante movimento, sob qualquer temperatura. Porém, algumas dessas moléculas se movimentam com mais velocidade do que outras e, por esse motivo, podem “fugir” do líquido e passar para a atmosfera sob a forma de vapor. Esse fenômeno é chamado de vaporização.
É importante ressaltar que o processo de vaporização se dá de três maneiras:
- Evaporação – vaporização lenta que ocorre na superfície do líquido, sem agitação e nem surgimento de bolhas. É esse processo que ocorre na secagem da roupa no varal.
- Ebulição – vaporização rápida, em que há agitação do líquido e surgimento de bolhas.
- Calefação – vaporização imediata que ocorre quando o líquido é posto em contato com uma superfície ultra aquecida.
Agora vamos pensar numa nova situação, na qual uma substância líquida está armazenada numa garrafa onde haja vácuo. Observando uma situação como esta, perceberemos que:
- no começo, a evaporação do líquido é rápida,
- com o decorrer do tempo, essa evaporação fica mais lenta,
- e, no final, ela cessa.
Como isso pode ser explicado?
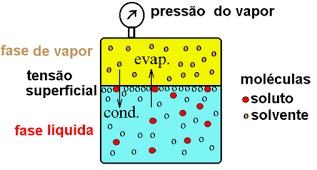 Nessa situação, assim como ocorre com a roupa secando no varal, as moléculas de água do recipiente fechado também “fogem” do líquido, mudando para o estado gasoso. Na forma de vapor, a velocidade com que as moléculas se movimentam é bem maior do que na fase líquida, o que provoca um maior número de colisão entre elas e contra as paredes da garrafa e, com isso, algumas dessas moléculas voltam ao estado líquido. A passagem de uma substância do estado gasoso para o estado líquido é chamada de condensação.
Nessa situação, assim como ocorre com a roupa secando no varal, as moléculas de água do recipiente fechado também “fogem” do líquido, mudando para o estado gasoso. Na forma de vapor, a velocidade com que as moléculas se movimentam é bem maior do que na fase líquida, o que provoca um maior número de colisão entre elas e contra as paredes da garrafa e, com isso, algumas dessas moléculas voltam ao estado líquido. A passagem de uma substância do estado gasoso para o estado líquido é chamada de condensação.
Num dado momento, a velocidade com que as moléculas evaporam se iguala à velocidade com que os seus vapores se condensam, por isso, temos a sensação de que a vaporização parou de ocorrer. Nesse momento, então, podemos dizer que o líquido e os vapores entraram em equilíbrio dinâmico e que a pressão de vapor do líquido foi atingida.
Substâncias líquidas diferentes apresentam pressões de vapor também diferentes. Isso porque tal propriedade física está completamente associada à intensidade das interações entre suas moléculas. Forças intermoleculares mais intensas, como é o caso das pontes de hidrogênio, provocam maior aderência entre as moléculas, tornando o líquido menos volátil, logo, sua pressão de vapor será menor. Por outro lado, quando a interação entre as moléculas é menos intensa, como nas forças de Van der Waals, o líquido é mais volátil, pois ligações fracas são rompidas com maior facilidade. Um exemplo de líquido volátil é o éter comum.
Veja no quadro abaixo os valores das pressões de vapor para alguns líquidos:
| Substância | Pressão de vapor (mmHg) a 25 °C |
| Água | 17,5 |
| Álcool | 44 |
| Éter | 442 |
Dessa forma, dizemos que quanto maior for a pressão de vapor de um líquido, maior será sua volatilidade.
Ao contrário do que se pensa, a pressão de vapor de um líquido não depende do volume do líquido, mas sim, da temperatura. Quando a temperatura do líquido aumenta, a energia cinética de suas moléculas também aumenta, tornando-as mais agitadas e facilitando a vaporização do líquido. Consequentemente, a quantidade de moléculas na forma de vapor aumenta, ou seja, a pressão de vapor dessa substância é maior.
Observe no quadro a variação da pressão de vapor da água em função da temperatura.
| Temperatura (°C) | Pressão máxima de vapor (mmHg) |
| 0 | 4,6 |
| 50 | 92,5 |
| 100 | 760,0 |
Essa propriedade física influi, ainda, no ponto de ebulição do líquido. Quando aquecemos um líquido num recipiente aberto, é possível notar a formação de bolhas no seu interior. Essas bolhas são constituídas do vapor do líquido e, para que elas escapem, é preciso que sua pressão seja, pelo menos, igual à pressão atmosférica.
Desse modo, podemos concluir que um líquido entra em ebulição quando, naquelas condições de temperatura, a pressão máxima de vapor se iguala à pressão atmosférica.
Referências bibliográficas
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso