Para formarmos uma solução, precisamos adicionar uma porção de soluto (substância que será dissolvida) numa quantidade de solvente (substância presente em maior quantidade, que dissolverá o soluto). A capacidade que uma substância apresenta de ser dissolvida em outra recebe o nome de solubilidade.
Mas, por que as substâncias se misturam, de modo a formar uma solução, enquanto outras não o fazem? Por que a água pode se misturar com o álcool, mas não com a gasolina, por exemplo?
Isso se deve às ligações químicas que existem entre as moléculas de cada substância. A água é uma substância polar, cujas moléculas são unidas por pontes de hidrogênio. O álcool também é uma substância polar, suas moléculas são ligadas por pontes de hidrogênio mais fracas que as da água. Já a gasolina é uma substância apolar, entre suas moléculas existem ligações de van der Waals, que são ligações ainda mais fracas do que as pontes de hidrogênio.
Assim sendo, ao misturarmos água e álcool, as ligações intermoleculares tanto da água quanto do álcool são quebradas, o que permite a formação de novas ligações, também do tipo pontes de hidrogênio. Já a mistura de água e gasolina não resulta numa solução, pois suas moléculas não se unem devido às diferenças de polaridade.
Com base em situações como essas, os estudiosos chegaram a uma regra de solubilidade:
Substâncias polares tendem a se dissolver em solventes polares, assim como substâncias apolares tendem a se dissolver em solventes apolares.
Dessa forma, vários compostos inorgânicos como ácidos, bases e sais, que são polares, se dissolvem em água, que é um solvente polar. Por outro lado, os compostos orgânicos, que geralmente são apolares, se dissolvem em solventes orgânicos, que também são apolares, em geral.
É possível notar que a água dissolve várias substâncias, sendo, por isso, chamada de solvente universal.
Coeficiente de solubilidade
Ao preparar uma mistura de 500 g de açúcar (C12H22O11) em 1 L de água, será formada uma solução. No entanto, se adicionarmos 500 g de sal de cozinha (NaCl) em 1 L de água, uma porção do sal será dissolvida e outra pequena porção ficará depositada no fundo do recipiente, o que chamamos de corpo de fundo. Esse é um exemplo claro de que substâncias diferentes se dissolvem em quantidades diferentes na mesma quantidade de solvente e na mesma temperatura.
Numa solução de água e sal, por exemplo, 1 litro de água pode dissolver até 360 g de sal em temperatura ambiente. Então, dizemos que uma solução com essas quantidades é chamada de solução saturada, pois alcançou o seu ponto de saturação. O ponto de saturação varia conforme o solvente, o soluto e as condições físicas, como a temperatura e a pressão, e é estabelecido pelo coeficiente de solubilidade.
Coeficiente de solubilidade é a quantidade máxima de soluto que pode ser dissolvida numa quantidade padrão de solvente, em determinadas condições de temperatura e pressão.
Logo, o coeficiente de solubilidade do sal de cozinha é de 360 g de NaCl/ 1 L de água a 20 °C.
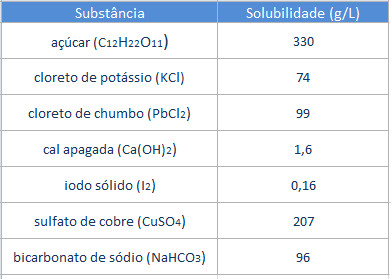
Observe os valores de solubilidade de algumas substâncias em 1 litro de água a 20 °C na tabela abaixo:
De acordo com o ponto de saturação, as soluções são classificadas em:
- insaturadas (ou não saturadas) – quando contêm uma quantidade de soluto menor do que a estabelecida pelo coeficiente de solubilidade;
- saturadas – quando atingem o coeficiente de solubilidade;
- supersaturadas – quando a quantidade de soluto ultrapassa o coeficiente de solubilidade.
Dizemos que duas substâncias são totalmente miscíveis quando elas se dissolvem em qualquer quantidade, como é o caso da água com álcool. Nessas situações, o coeficiente de solubilidade é infinito.
Pelo contrário, existem substâncias que praticamente não se dissolvem num dado solvente, como ocorre com o cloreto de prata (AgCl), cujo coeficiente de solubilidade em água é de 0,014 g/L. Nesses casos, dizemos que a substância é insolúvel naquele solvente.
Fatores que afetam a solubilidade
Além das propriedades do soluto e do solvente, dois fatores exercem influência sob a solubilidade: temperatura e pressão.
Temperatura
Na maioria das substâncias, há um aumento da solubilidade com o aumento da temperatura. Isso geralmente acontece quando o soluto é dissolvido com absorção de calor, o que chamamos de dissolução endotérmica. Por outro lado, existem substâncias que se dissolvem com liberação de calor e, por isso, tendem a ser menos solúveis com o aumento da temperatura, o que recebe o nome de dissolução exotérmica.
A variação dos coeficientes de solubilidade das substâncias em função da temperatura pode ser expressa em gráficos denominados curvas de solubilidade. Veja alguns exemplos:
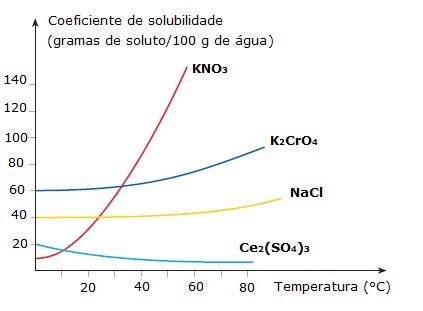
Perceba que as solubilidades do nitrato de potássio (KNO3), do cromato de potássio (K2CrO4) e do cloreto de sódio (NaCl) aumentam com a elevação da temperatura (curva ascendente). Em contrapartida, o sulfato de cério (Ce2(SO4)3) tem sua solubilidade diminuída com o aumento da temperatura (curva descendente).
Pressão
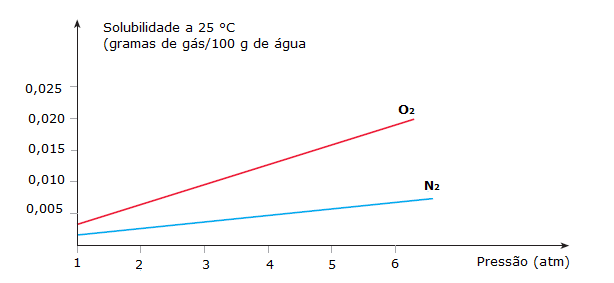
A pressão tem grande influência nas soluções que contêm gases. A solubilidade de gases em solventes líquidos muito depende da pressão. Quando aumentamos a pressão sobre o gás, de certa forma, o gás é “empurrado” para dentro do líquido, ou seja, sua solubilidade aumenta.
Quando o gás não reage com o líquido da solução, a lei de Henry explica a influência da pressão nesse sistema, dizendo que:
A solubilidade de um gás num líquido é diretamente proporcional à pressão sobre o gás, em temperatura constante.

Referências
FELTRE, Ricardo. Química volume 2. São Paulo: Moderna, 2005.
MACHADO, Andrea Horta, MORTIMER, Eduardo Fleury. Química volume único. São Paulo: Scipione, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Por: Mayara Lopes Cardoso
Veja também:
- Substâncias e Misturas
- Produto de Solubilidade
- Solubilidade de Compostos Orgânicos
- Soluções e Dispersões
- Classificação das Soluções