A ligação iônica consiste na união de íons com cargas de sinais contrários, mediante forças eletrostáticas. Ocorre com a transferência de elétrons de um átomo para outro, formando cátions (íons positivos) e ânions (íons negativos), que se atraem mutuamente.
Essa ligação química, portanto, ocorre entre elementos que têm grandes diferenças na eletronegatividade, formando aglomerados de íons. Quanto maior for a diferença de eletronegatividade entre esses elementos, maior será o caráter iônico da ligação.
Acontece entre: metal + não metal e metal + hidrogênio.
Formação de compostos iônicos
As ligações iônicas ocorrem, como regra geral, entre os elementos que tendem a perder elétrons (baixa eletronegatividade), os quais têm 1, 2 ou 3 elétrons na última camada (metais), e os elementos que tendem a ganhar elétrons (alta eletronegatividade), os quais têm 5, 6 ou 7 elétrons na última camada (não metais).
- Metal ⇒ menos de 4 elétrons na última camada. Doam elétrons; transformam-se em cátions (íons positivos).
- Não metal ⇒ mais de 4 elétrons na última camada. Recebem elétrons; transformam-se em ânions (íons negativos).
Após a transferência de elétron do metal para o não metal, ocorre forte atração eletrostática entre os íons de cargas opostas (ligação iônica).
Exemplo 1
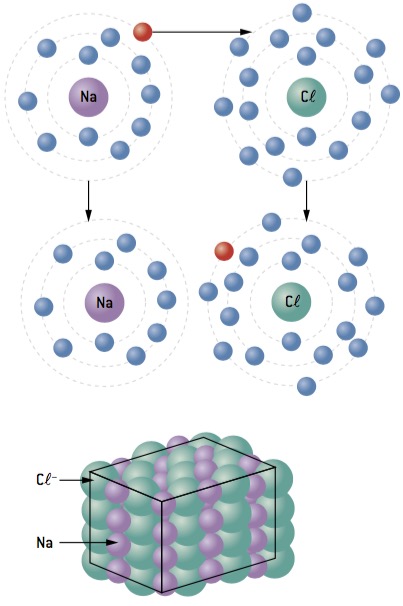
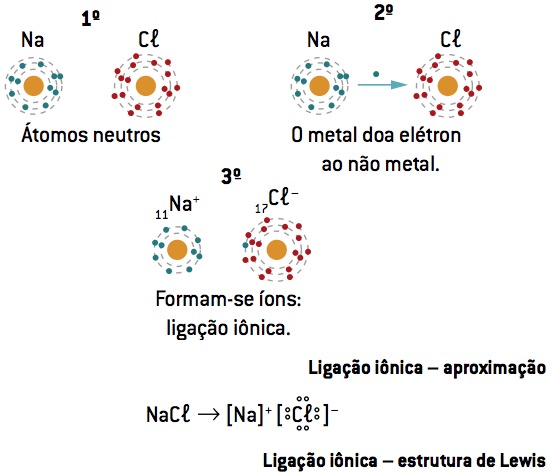
Ligação química entre sódio (11Na) e cloro (17Cl):
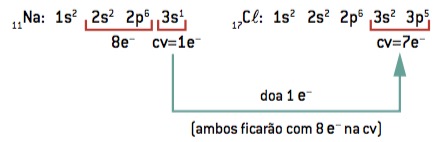 11Na: 1s2 2s2 2p6 3s1 (1 e– na CV/perde 1 e–) ⇒ Na+
11Na: 1s2 2s2 2p6 3s1 (1 e– na CV/perde 1 e–) ⇒ Na+
17Cl: 1s2 2s2 2p6 3s2 3p5 (7 e– na CV/ganha 1 e–) ⇒ Cl–
O átomo de sódio perde 1 elétron, enquanto o átomo de cloro ganha 1 elétron; então, para que o total de elétrons perdidos seja igual ao total de elétrons ganhos, 1 sódio (perda de 1 e–) se liga a 1 cloro (ganho de 1 e–).
Na+ Cl– ⇒ NaCl composto iônico
Observação: Na representação de um composto iônico, o cátion (+) sempre vem na frente do ânion (–).
Exemplo 2
Ligação química entre cálcio (20Ca) e flúor (9F):
9F: 1s2 2s2 2p5 (7 e– na CV/ganha 1 e–) ⇒ F–
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2 (2 e– na CV/perde 2 e–) ⇒ Ca2+
Cada átomo de cálcio perde 2 elétrons, enquanto o átomo de flúor ganha 1 elétron; então, para que o total de elétrons perdidos seja igual ao total de elétrons ganhos, 1 átomo de cálcio (perde 2 e–) se liga a 2 átomos de flúor (ganho de 2 e–).
Ca2+ F– ⇒ CaF2 composto iônico
Exemplo 3
Ligação química entre oxigênio (8O) e alumínio (13Aℓ):
8O: 1s2 2s2 2p4 (6 e– na CV/ganha 2 e–) ⇒ O2–
13Aℓ: 1s2 2s2 2p6 3s2 3p1 (3 e– na CV/perde 3 e–) ⇒ Aℓ3+
Aℓ3+O2– ⇒ Aℓ2O3 composto iônico
Observação: Os compostos iônicos (compostos que apresentam ligação iônica) são eletricamente neutros, ou seja, a soma total das cargas positivas é igual à soma total das cargas negativas.
Notação ou fórmula de Lewis
Esta fórmula representa os elementos por meio dos elétrons do último nível (elétrons de valência), indicando-os por pontos.
Características dos compostos iônicos
Os compostos iônicos possuem uma estrutura cristalina independentemente de sua natureza. Esse fato confere a todos eles propriedades características dentre as quais destacam-se:
- são sólidos à temperatura ambiente. As forças de atração são tão fortes que os íons seguem ocupando suas posições na rede cristalina, mesmo a centenas de graus Celsius de temperatura. Portanto, são rígidos e fundem-se a temperaturas elevadas;
- em estado sólido, não conduzem corrente elétrica, mas são condutores quando dissolvidos ou fundidos. Ao introduzir dois eletrodos, um positivo e outro negativo, em uma dissolução iônica, cria-se um fluxo de cargas elétricas ou de íons – os ânions são atraídos pelo ânodo e repelidos pelo cátodo e os cátions são atraídos pelo cátodo e repelidos pelo ânodo. Esse fenômeno é chamado condutividade iônica;
- têm altas temperaturas de fusão e de ebulição devido à forte atração entre os íons. Por isso, podem ser usados como material refratário;
- são duros e quebradiços. A dureza, entendida como resistência a ser riscado, é considerável nos compostos iônicos; essa resistência pode ser explicada pela dificuldade em quebrar uma estrutura cristalina (altamente estável) por meio de um procedimento mecânico;
- oferecem muita resistência à dilatação. O aumento de volume supõe um enfraquecimento das forças de atração iônica;
- são, em geral, solúveis em água. As soluções obtidas são boas condutoras de eletricidade (eletrolíticas).
Por: Paulo Magno da Costa Torres