Experimento de Rutherford
Em 1896, descobriu-se que alguns elementos eram radioativos, isto é, capazes de emitir radiação de alta energia. Constatou-se que a radiação emitida por eles poderia ser de três tipos: partículas alfa (α), partículas beta (β) e raios gama (γ).
Uma partícula alfa carrega carga positiva e tem massa muito maior que a de um elétron.
De posse dessas e de outras informações correntes, em 1911, o físico neozelandês Ernest Rutherford (1871-1937) realizou um experimento que consistiu em bombardear com partículas o, emitidas por uma amostra do elemento radioativo polônio, uma finíssima lâmina de ouro. Para estudar as trajetórias das partículas, atrás da lâmina de ouro colocou-se uma placa fotográfica. Constatou-se que:
- a maioria das partículas atravessava a lâmina de ouro sem se desviar
- uma pequena fração das partículas atravessou a lâmina com um ligeiro desvio na trajetória;
- apenas uma em cada 10 mil partículas não atravessava a lâmina e ricocheteava
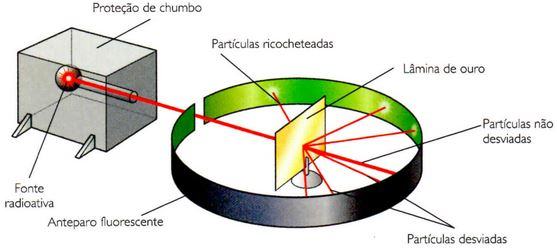
Reprodução esquemática do experimento de Rutherford. A espessura da lâmina de ouro era de aproximadamente 0,0005 mm, o que corresponde a cerca de 400 átomos de ouro dispostos lado a lado.
O modelo atômico de Rutherford
Baseando-se em seu experimento, Rutherford elaborou um modelo atômico, que ficou conhecido como modelo planetário do átomo. Segundo o físico, o átomo é formado por uma parte central — o núcleo — e por uma parte envolvente periférica — a eletrosfera:
- no núcleo, concentra-se a carga positiva (prótons) e a maior parte da massa do átomo;
- o na eletrosfera, girando ao redor do núcleo, estão os elétrons. Essa região ocupa a maior parte do volume atômico,
Dessa maneira:
- A maioria das partículas atravessou a lâmina de ouro sem sofrer desvio. Porque o átomo é constituído em grande parte por espaço vazio.
- Uma pequena fração atravessou a lâmina com um ligeiro desvio em sua trajetória. As partículas que sofreram desvio atravessaram a lâmina nas proximidades de um núcleo de ouro. Como o núcleo é positivo, ele repele a partícula alfa (também positiva).
- Apenas uma de cada 10 mil partículas ricocheteou após bater na lâmina, não atravessando-a. As partículas ricocheteadas foram repelidas pelo núcleo do átomo de ouro. O tamanho do núcleo é cerca de 10 mil vezes menor que o tamanho do átomo.
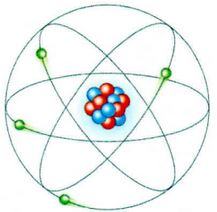
Um pouco depois, em 1920, Rutherford propôs a existência de outra partícula no núcleo. Ele a chamou de nêutron e estimou que sua massa seria igual à do próton e que ela não teria carga elétrica. A existência dessa partícula só foi confirmada experimentalmente em 1932, com os experimentos do físico britânico James Chadwick (1891-1974).
O modelo atômico de Rutherford é capaz de explicar perfeitamente seu experimento.
Por: Paulo Magno da Costa Torres