Os modelos atômicos propostos indicam que os átomos diferem entre si pelo número de prótons, nêutrons e elétrons que contêm. Para identificar o número dessas partículas, são determinados o número de massa e o número atômico.
As massas atômicas são determinadas por comparação das massas dos átomos com um padrão de massas que equivale a 1/12 da massa do átomo de carbono. O valor numérico da massa atômica é muito próximo do valor do número de massa.
O número de massa e o número atômico
Um átomo pode ser definido mediante dois números:
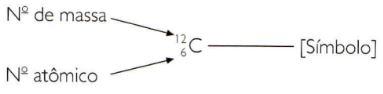
- O número atômico, cujo símbolo é Z, é o número de prótons que tem um átomo. Como o átomo isolado é neutro, o número de prótons coincide com o número de elétrons.
- O número de massa, cujo símbolo é A, é o número de partículas que tem um átomo em seu núcleo. É a soma de prótons e nêutrons.
A = Z + N
O que realmente identifica o elemento a que pertence o átomo é o número atômico (Z). O valor de A é útil, mas não identifica de que elemento é o átomo em questão.
Representação abreviada dos átomos
Como saber se dois átomos são do mesmo elemento ou de elementos diferentes?
Se dois átomos têm o mesmo número atômico, isto é, o mesmo número de prótons em seu núcleo, pode-se afirmar que são do mesmo elemento. Assim, a atual definição de elemento químico diz que elemento químico é um conjunto de átomos que têm o mesmo número atômico.
Para indicar os números atômico e de massa de um elemento de maneira abreviada, deve-se representar o número atômico como um índice subscrito à esquerda do símbolo e o número de massa como um índice sobrescrito também à esquerda do símbolo.
O tamanho dos átomos
Como um angstrom (Å) vale 00000000001 m (10-10 m), pode-se usar essa unidade de medida para medir os raios do núcleo e do átomo.
Raio do núcleo (rn) = 10-4 Å.
Raio do átomo (ra) = 1 Å.
A massa atômica
Já se conhecem as partículas que fazem parte do átomo. Como fazer para estimar a sua massa? Em que unidade ela pode ser medida? Expressar as massas dos átomos em gramas não parece adequado, uma vez que essa unidade é muito grande para uma partícula tão pequena e tão leve quanto o átomo.
Definiu-se, então, uma nova unidade, a unidade de massa atômica (u). A unidade de massa atômica (u) equivale a um doze avos da massa do carbono de número de massa 12. A unidade de massa atômica é praticamente a massa de um próton.
Por: Paulo Magno da Costa Torres