Embora a ciência já tenha chegado a dezenas de estados físicos possíveis da matéria – alguns deles intermediários – quando estudamos a forma com que as substâncias se apresentam na superfície da Terra, temos três estados físicos da matéria possíveis, com efeitos visíveis a olho nu: sólido, líquido e gasoso.
Mesmo de forma visível, as substâncias passam por modificações de volume, textura e formato, conforme a temperatura e a pressão às quais estão submetidas. Em termos microscópicos, os estados da matéria correspondem a fases específicas de agregação ou coesão das moléculas e átomos, além da intensidade de movimento, o que varia conforme temperatura e pressão.
As moléculas permanecem mais unidades e mais coesas, além de permanecerem menos móveis em algumas circunstâncias. Nesses casos, temos o estado sólido. À medida que a temperatura e a pressão sobem, moléculas entram em estado de agitação e perdem a coesão, aumentando o distanciamento – criando o estado líquido ou o gasoso.
Estado sólido
No estado sólido, as partículas de uma substância encontram-se num estado interno ordenado e regular. Moléculas e átomos estão mais próximos e mantêm movimentos discretos. As partículas se comprimem e possuem uma estrutura coesa, apenas vibrando em posições relativamente fixas. Isso faz com que o material mantenha um volume e uma forma definidos. Isso não impede, no entanto, que o material sofra deformações. Contudo, as formas e o tamanho de um sólido não sofrem influência do recipiente onde ele está contido. Os sólidos são rígidos, densos, quebradiços, maleáveis, flexíveis e apresentam alta resistência a deformações.
Estado líquido
No estado líquido, partículas encontram-se em um estado mais desorganizado e caótico. A mobilidade das partículas aumenta e moléculas e átomos deslizam uns sobre os outros. Essa característica concede aos líquidos vazão e faz com que o material não assuma uma forma definida – ela depende apenas do recipiente que contém a matéria.
A proximidade entre as partículas, no entanto, ainda é suficiente para que a matéria mantenha um volume constante, independentemente da forma.
Estado gasoso
No estado gasoso, as forças de atração entre as partículas tornam-se insuficientes para vencer a energia cinética e o movimento delas. Em outras palavras, os gases não conseguem manter uma estrutura definida.
Como resultado, partículas movimentam-se sem qualquer ordenação e de forma aleatória e em alta velocidade. Nesse estado, tanto o volume quanto a forma são variáveis, embora os gases possam ser comprimidos ou expandidos quando encontram-se em um recipiente que o permita.
O quarto estado: plasma
Ainda na Terra, em condições naturais, há um quarto estado possível da matéria – o plasma. O estado plasmático ocorre quando gases são submetidos a temperaturas e pressão ou gravidade extremas.
No núcleo da Terra, assim como no Sol em outras estrelas, o plasma é o estado preponderante da matéria. Nesse estado, moléculas são dissolvidas e reduzidas aos seus átomos constituintes, formando uma massa densa e ionizada.
A ciência ainda descobriu outros estados da matéria, que apenas podem ser reproduzidos em experimentos utilizando temperaturas próximas do zero absoluto ou são encontrados em condições raras, como no núcleo de estrelas de nêutrons, na ocorrência de supernovas ou em estrelas em formação.
Mudanças de estado físico
Toda substância possui pontos específicos nos quais o seu estado físico é modificado. Essas mudanças variam conforme a composição de cada material e são influenciados pela temperatura e pressão.
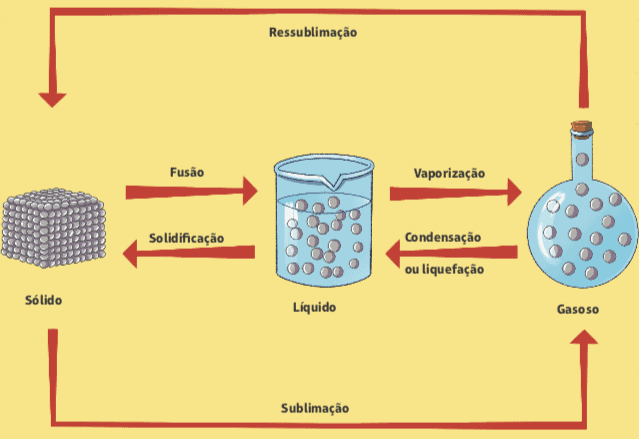
Fusão e solidificação
A fusão é a passagem do estado sólido para o líquido, quando há aumento de temperatura ou redução da pressão. À medida que se aproximam do seu ponto de fusão, as substâncias iniciam um processo de derretimento. A passagem é em geral gradual. O processo inverso, que é a passagem do líquido para o estado sólido, é chamado de solidificação.
Vaporização
Outra mudança de estado físico da matéria é a vaporização, que consiste na passagem do estado líquido para o gasoso – ou vapor. Estamos bastante acostumados a lidar com a vaporização no caso da água, mas ela em tese ocorre com qualquer outro material. A vaporização é dividida em três tipos ou processos distintos:
- Na evaporação, há uma passagem lenta e gradual do estado líquido para o gasoso, como ocorre quando secamos uma roupa no varal.
- Na ebulição, aplicamos energia calorífica a um líquido, que esquenta e atinge a temperatura de vaporização, a partir da qual o líquido começa a evaporar de maneira acelerada.
- A calefação, por outro lado, é um processo quase instantâneo. O líquido, em contato com uma fonte de calor poderosa, torna-se um gás em segundos, formando uma camada de vapor entre os estados sólido e líquido.
Condensação ou liquefação
Gases podem passar ao estado líquido quando sofrem uma queda de temperatura acentuada. A condensação ocorre na nossa vida a todo momento. O vapor do banho que condensa e escorre pelo box, quando atinge a superfície fria.
Esse fenômeno é chamado de condensação ou liquefação, que é a passagem do vapor para o líquido. Como a água fervendo numa panela de arroz. A água inicia vaporização, mas ao tocar a tampa da panela, mais fria, cria gotículas que pingam e escorrem.
Sublimação
Algumas substâncias específicas possuem uma característica peculiar: quando a temperatura se eleva, porções sólidas desses materiais tornam-se gases, e não líquidos. Isso ocorre com a naftalina, mas também com cristais de iodo, ácido benzóico e com o gelo seco, usado por vendedores de sorvete e picolés.Esse processo é chamado de sublimação, e o oposto (passagem do vapor para o sólido) pode ser chamado também de sublimação ou, ainda, de ressublimação.
Todas as passagens de estados físicos da matéria (ao menos os três mais comuns), podem ser resumidos num esquema relativamente simples.
Por: Carlos Artur Matos
Veja também:
- Mudanças de Estado Físico da Matéria
- Estados Físicos da Água
- Propriedades Gerais da Matéria
- Substâncias e Misturas
- Densidade