A reação de neutralização ou salificação (produção de um sal) é uma das reações mais clássicas da química e consiste em fazer reagir um ácido com uma base, formando um sal e uma base.
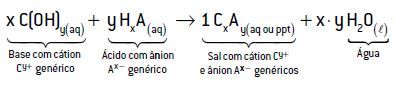
Em uma reação de neutralização, o íon H+ (lembre-se de que H+ é a representação simplificada que se usa para o íon H3O+), proveniente do ácido, reage com as hidroxilas (OH–), provenientes das bases, com o objetivo de se neutralizarem, formando a água.
Reação de neutralização total
A reação de neutralização total consiste em fazer reagir todos os íons H+ com as hidroxilas (OH–), originando, além da água, um sal, que é denominado neutro ou comum.
A nomenclatura do sal comum consiste em fornecer o nome do ânion (proveniente do ácido) e o nome do cátion (proveniente da base).
Nomenclatura do ânion + “de” + nomenclatura do cátion
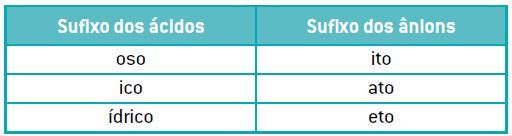
A nomenclatura dos ânions depende da nomenclatura dos ácidos e acompanha o padrão apresentado na tabela a seguir
Seguem alguns exemplos de reações de neutralização total.
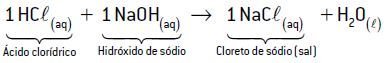
Exemplo 1: HCl e NaOH
Como a quantidade de hidrogênios ionizáveis do ácido clorídrico (HCl) é igual à quantidade de hidroxila do hidróxido de sódio (NaOH), a proporção estequiométrica será de 1:1 para ocorrer uma neutralização total.
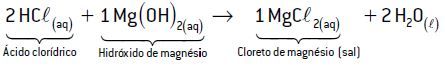
Exemplo 2: HCl e Mg(OH)2
Têm-se um hidrogênio ionizável no ácido clorídrico (1 H+) e duas hidroxilas no hidróxido de magnésio (2 OH–). Para a reação ser de neutralização total, a proporção de ácido-base será de 2:1, respectivamente.
Exemplo 3: H2SO4 e Ca(OH)2
Têm-se dois hidrogênios ionizáveis no ácido sulfúrico (2 H+) e duas hidroxilas no hidróxido de cálcio (2 OH–). Como a quantidade de H+ é igual à quantidade de OH–, para a reação ser de neutralização total, a proporção de ácido-base será de 1:1, respectivamente.
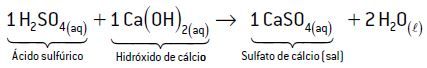
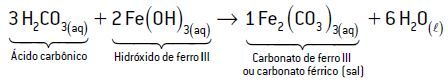
Exemplo 4: H2CO3 e Fe(OH)3
Têm-se dois hidrogênios ionizáveis no ácido carbônico (2 H+) e três hidroxilas no hidróxido de ferro III (3 OH–). Para a reação ser de neutralização total, a proporção de ácido-base será de 3:2, respectivamente.
Exemplo 5: H3PO3 e Al(OH)3
Têm-se dois hidrogênios ionizáveis no ácido fosforoso (2 H+) e três hidroxilas no hidróxido de alumínio (3 OH–). Para a reação ser de neutralização total, a proporção de ácido-base será de 3:2, respectivamente.

Observação: Apesar de ter sobrado um átomo de hidrogênio no sal fosfito de alumínio, essa neutralização é total, uma vez que esse hidrogênio está diretamente ligado ao átomo de fósforo e, por isso, não é ionizável.
Reação de neutralização parcial
As reações de neutralização são consideradas parciais quando não ocorre o consumo total de H+ ou de OH–. Os sais formados são denominados sais ácidos (hidrogenossal) ou básicos (hidroxissal).
Reação de neutralização parcial do ácido
Na reação de neutralização parcial de um ácido, os hidrogênios ionizáveis não são totalmente consumidos, originando sais ácidos ou hidrogenossais.
Exemplo 1: reação de 1 mol de H2CO3 com 1 mol de NaOH
Quando 1 mol de H2CO3 (2 H+) reage com 1 mol de NaOH (1 OH–), ocorre a formação de apenas 1 mol de H2O, o que faz sobrar 1 mol de íons H+, não consumido pela base. Nessa reação, origina-se um sal ácido (NaHCO3).
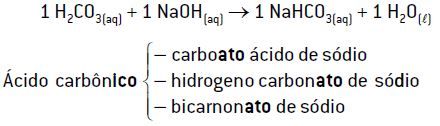
Observação: O prefixo bi, do ânion bicarbonato, indica que o ácido de origem é um oxiácido, que apresenta dois hidrogênios ionizáveis (nomenclatura usual).
Exemplo 2: reação de 1 mol de H3PO4 com 1 mol de NaOH
Quando 1 mol de H3PO4 (3 H+) reage com 1 mol de NaOH (1 OH–), ocorre a formação de apenas 1 mol de H2O com sobra de 2 mols de H+ não consumidos pela base. Nessa reação, origina-se um sal ácido (NaH2PO4).

Exemplo 3: reação de 1 mol de H3PO4 com 2 mols de NaOH
Quando 1 mol de H3PO4 (3 H+) reage com 2 mols de NaOH (2 OH–), ocorre a formação de 2 mols de H2O; na reação, resta 1 mol de H+, não consumido pela base. Nessa reação, origina-se um sal ácido (Na2HPO4).

Exemplo 4: reação de 1 mol de H3PO4 com 1 mol de Mg(OH)2
Quando 1 mol de H3PO4 (3 H+) reage com 1 mol de Mg(OH)2(2 OH–), ocorre a formação de 2 mols de H2O com sobra de um hidrogênio, não consumido pelo ácido. Essa reação origina um sal ácido (MgHPO4).

Reação de neutralização parcial da base
Na reação de neutralização parcial de uma base, as hidroxilas (OH–) são totalmente consumidas, originando sais básicos ou hidroxissais.
Exemplo 1: reação de 1 mol de HCl com 1 mol de Mg(OH)2
Quando 1 mol de HCl(1 H+) reage com 1 mol de Mg(OH)2 (2 OH–), ocorre a formação de apenas 1 mol de H2O, o que implica 1 mol de íons hidroxila não consumido pelo ácido. Nessa reação, origina-se um sal básico (Mg(OH)Cl).
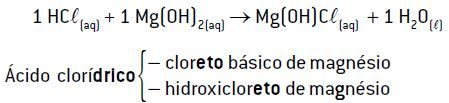
Exemplo 2: reação de 1 mol de HNO2 com 1 mol de Al(OH)3
Quando 1 mol de HNO2 (1 H+) reage com 1 mol de Al(OH)3 (3 OH–), ocorre a formação de apenas 1 mol de H2O com sobra de 2 mols de íons OH–, não consumidos pelo ácido. Nessa reação, origina-se um sal básico (Al(OH)2NO2).
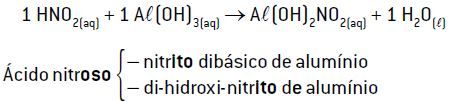
Por: Wilson Teixeira Moutinho