As transformações gasosas são modificações que provocamos nas variáveis de estado da mesma massa de um gás.
Transformação isotérmica
A transformação isotérmica ocorre quando alteramos a pressão e o volume de um gás, mas não alteramos a sua temperatura.
Este tipo de transformação pode ser observado quando pisamos numa bexiga cheia e ela estoura. Por quê?
Porque o que ocorre neste fato é que, pisando na bexiga, diminuímos seu volume, consequentemente, o gás em seu interior agora ocupa um menor espaço e se choca mais e com maior intensidade com a parede interna da bexiga, o que indica aumento na pressão interna. Com isso, a borracha que compõe a bexiga não aguenta e estoura.
Experimentalmente, observamos o seguinte:
| Pressão | Volume |
| P | V |
| 2P | V/2 |
| 3P | V/3 |
Então, notamos que a pressão é inversamente proporcional ao volume, mantendo-se constante a temperatura.
Matematicamente, temos:
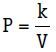
P · V = k (constante)
Podemos demonstrar o que ocorre com o gás antes e depois da variação da pressão e do volume da seguinte forma:
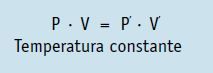
Transformação isobárica
A transformação isobárica ocorre quando alteramos a temperatura e o volume de um gás, mas não alteramos a sua pressão.
Com o aumento da temperatura, já sabemos que as partículas do gás ganham mais energia e se chocam mais intensamente contra as paredes do frasco. Para evitar o aumento da pressão, o volume também aumenta na mesma proporção, pois, assim, os choques continuam com a mesma intensidade, sendo que as partículas agora têm de percorrer um caminho maior, mantendo, consequentemente a pressão do sistema.
Experimentalmente, observamos o seguinte:
| Volume | Temperatura |
| V | T |
| 2V | 2T |
| 3V | 3T |
Então, notamos que o volume é diretamente proporcional à temperatura, mantendo-se constante a pressão.
Matematicamente, temos:
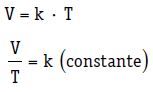
Podemos demonstrar o que ocorre com o gás antes e depois da variação do volume e da temperatura da seguinte forma:

Transformação isocórica (isométrica ou isovolumétrica)
A transformação isocórica ocorre quando alteramos a pressão e a temperatura de um gás, mas não alteramos o seu volume.
Esse tipo de transformação nos ajuda a entender por que uma lata de spray estoura quando é colocada no fogo. Com o aumento da temperatura, as partículas que compõem o gás ganham mais energia e se agitam mais, aumentando a intensidade e o número de choques contra as paredes da lata, provocando aumento na pressão. Como o volume não se altera, o metal que compõe a lata não resiste e estoura.
Experimentalmente, observamos o seguinte:
| Pressão | Temperatura |
| P | T |
| 2P | 2T |
| 3P | 3T |
Então, notamos que a pressão é diretamente proporcional à temperatura, mantendo-se o volume constante.
Matematicamente, temos:
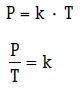 Podemos demonstrar o que ocorre com o gás antes e depois da variação da pressão e da temperatura da seguinte forma:
Podemos demonstrar o que ocorre com o gás antes e depois da variação da pressão e da temperatura da seguinte forma:
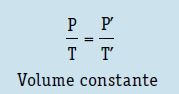
ATENÇÃO!
Vale lembrar que, no estudo dos gases, todas as temperaturas devem estar na escala Kelvin de temperatura.
Equação geral dos gases
Se relacionarmos as três equações vistas até aqui, teremos:
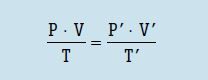
Note que, dessa equação, tiramos as três equações das transformações gasosas:

Por: Wilson Teixeira Moutinho